
近日,CDE最新公示消息,又一批藥品擬納入優先審評。包括百濟神州的替雷利珠單抗、信達首款小分子抗癌新藥pemigatinib片、協和麒麟的First-in-classCCR4抑制劑莫格利珠單抗等在內。
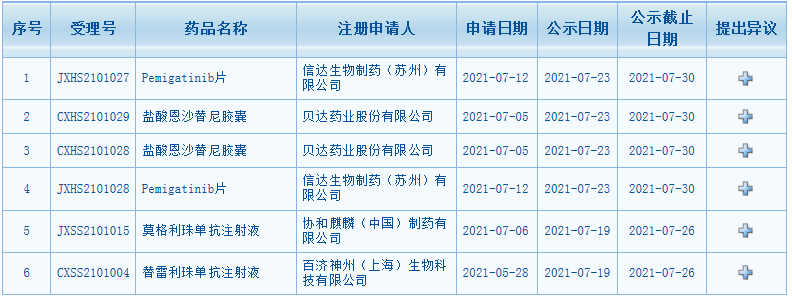
圖片來源:CDE
基石藥業艾伏尼布
艾伏尼布(Ivosidenib)是一款first-in-class、具有選擇性的、針對IDH1基因突變癌癥的強效口服靶向抑制劑。2018年7月獲得FDA批準上市,成為全球首個且唯一一個獲得FDA批準治療攜帶易感IDH1突變的成人復發或難治性急性髓系白血病(R/RAML)藥物。FDA還分別在2018年和2019年向此藥授予了用于急性髓細胞性白血病和膽管癌的孤兒藥稱號及突破性療法。
信達首款小分子抗癌新藥pemigatinib片
Pemigatinib屬于纖維細胞生長因子受體(FGFR)亞型1/2/3的強效選擇性口服抑制劑。據藥智數據藥品注冊時光軸顯示,pemigatinib申報上市被NMPA受理到納入優先審評僅僅只用了11天時間,適應癥為既往至少接受過一種系統性治療,且經檢測確認存在有FGFR2融合或重排的晚期、轉移性或不可手術切除的膽管癌成人患者的治療。

貝達藥業鹽酸恩沙替尼
鹽酸恩沙替尼是一種新型強效、高選擇性的新一代ALK抑制劑,是貝達藥業和控股子公司Xcovery共同開發的全新的、擁有完全自主知識產權的創新藥;是貝達藥業在肺癌領域繼EGFR-TKI后的又一重大布局產品,有望成為首個由中國企業主導在全球上市的肺癌靶向創新藥。
協和麒麟的First-in-classCCR4抑制劑莫格利珠單抗
莫格利珠單抗注射液(Mogamulizumab)是抗CC趨化因子受體4(CCR4)單克隆抗體,是由協和發酵株式會社研發,并已相繼在日本和美國上市。近日,這款First-in-classCCR4抑制劑在中國申報上市被受理,并快速納入擬納入優先審評名單,適用于既往接受過至少一次全身性治療的蕈樣肉芽腫(MF)或Sézary綜合征(SS)成人患者的治療。數據顯示,蕈樣真菌病占所有皮膚淋巴瘤的50%-70%,它能夠導致瘙癢的紅疹和皮膚傷口,且可擴散到身體其它部位;塞扎里綜合癥則是影響血液和淋巴結的一種罕見皮膚淋巴瘤;MF的白血病階段,與紅皮病相關聯,約占皮膚T細胞淋巴瘤的3%。

百濟神州百澤安擬納入優先審評
7月19日,CDE官網顯示,百濟神州PD-1抗體替雷利珠單抗上市申請擬納入優先審評,適應癥為適用于既往經治的局部晚期不可切除或轉移性高度微衛星不穩定型(MSI-H)或錯配修復缺陷型(dMMR)實體瘤。
信息與數據來源:藥智數據、CDE、企業官網、企業公告等公開數據與信息。

 冀公網安備 13010802000997號
冀公網安備 13010802000997號 微信掃一掃
微信掃一掃